قوانین ترمودینامیک ؛ چکیده قانون اول و دوم
قوانین ترمودینامیک ؛ چکیده قانون اول و دوم ؛ در این پست تلاش کرده ایم تا دو مورد از چهار قانون مشهور به قوانین ترمودینامیک (قانون صفر، قانون اول، قانون دوم، قانون سوم) را به صورتی چکیده معرفی کنیم. قوانین ترمودینامیک به چهار قانونی فیزیکی گفته میشود که از واحدهای اصلی فیزیک، (مانند فشار، انرژی و آنتروپی) برای توصیف سیستمهایترمودینامیکی در یک تعادلگرمائی استفاده میکند. قوانین عنوان شده به توضیح این موضوع میپردازند که هریک از این واحدهای اصلی در شرایط گوناگون چگونه رفتار میکنند و بعضی از پدیدهها مانند حرکتدایمی را منع مینماید.
قانون اول ترمودینامیک
گرما شکلی از انرژی و انرژی پایسته است. بیان این قانون به شکل معادله عبارت است از که WـQ=U∆ در آن U∆ تغییر انرژی داخلی سیستم است، Q انرژی گرمایی دریافتی سیستم، و کار W کار انجام شده در سیستم است (در فیزیک حرف بزرگ یونانی دلتا، ∆، نماینده «تغییر» در یک کمیت است). در «ترمودینامیک»، «ترمو» به معنی گرما و «دینامیک» به معنی کار است.
بیان این قانون به شکل معادله عبارت است از که WـQ=U∆ در آن U∆ تغییر انرژی داخلی سیستم است، Q انرژی گرمایی دریافتی سیستم، و کار W کار انجام شده در سیستم است (در فیزیک حرف بزرگ یونانی دلتا، ∆، نماینده «تغییر» در یک کمیت است). در «ترمودینامیک»، «ترمو» به معنی گرما و «دینامیک» به معنی کار است.
قانون اول یکی از مهمترین قانونهای فیریکی است. به زبان ساده، تکرار قانون بقای انرژی به خلق و نه از بین میرود، بلکه ممکن است از حالتی به حالت دیگر تغییر کند.
مایر پزشک فاقد تحصیلاتی در زمینه فیزیک بود. وقتی به عنوان پزشک در یک کشتی هلندی در جنوب شرقی آسیا خدمت میکرد پی برد که خون ملوانان بیش از حد سرخرنگ است. فکر میکرد که گرمای نواحی گرمسیر آهنگ سوخت و ساز را افزایش داده و در نتیجه به افزایش اکسیژن خون ملوانان انجامیده است. او در استدلال خویش یک گام پیشتر رفت: فعالیتهای عضلانی (کار) نیز گرما تولید میکنند و باید بین کار و گرما رابطهای برقرار باشد.
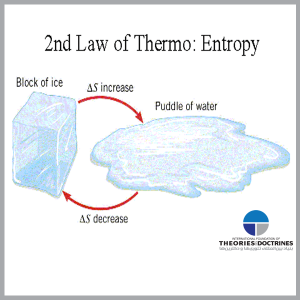
قانون دوم ترمودینامیک
گرما به خودی خود از جسم سردتر به جسم گرمتر جاری نمیشود. بنابراین قانون، بسیاری از فرایندها در طبیعت بازگشتناپذیرند و هیچگاه به عقب برنمیگردند.
احکام معادل قانون دوم فراوان اند، که هر کدام را دانشمند متفاوتی در زمان متفاوتی تدوین و اعلام کرده است. بنابراین قانون، بسیاری از فرایندها در طبیعت بازگشتناپذیرند و هیچگاه به عقب برنمیگردند: سوخت مصرف شده برای همیشه از بین میرود، املت را نمیتوان به تخم مرغ تبدیل کرد، ماشینهای منزوی نمیتوانند در حال حرکت دائم بمانند. این قانون جهت زمان را نیز تعیین میکند (زمان نمیتواند به عقب برگردد.)
در سال ۱۸۶۵ کلاوزیوس اصلاًح آنتروپی را به عنوان معیار بینظمی و یا کاتورهای بودن هر سیستم به کار برد. هرچه سیستم بینظمتر و کاتورهایتر باشد، آنتروپی آن افزایش مییابد، و هنگامی که به آب گرما میدهند و به بخار تبدیلاش میکنند آنتروپی آن حتی بسیار بیشتر هم میشود. آنتروپی هر سیستم بازگشتناپذیر باید افزایش یابد، بنابر این آنتروپی عالم در حال افزایش است.
بنابر قانون سوم ترمودینامیک، که سرد کردن یک جسم تا دمای صفر مطلق ناممکن است. این دما معادل Cº ۱۵/۲۷۳ (Fº ۶۷ º/۴۵۹) است.
جان دبلیو کمپل آمریکایی (۱۹۱۰ـ ۱۹۷۱) نویسنده داستانهای علمی ـ تخیلی قوانین ترمودینامیک را از این قرار تعبیر کرده است؛
اولین قانون ترمودینامیک: نمیتوانی ببری.
دومین قانون ترمودینامیک: نمیتوانی مساوی کنی.
سومین قانون ترمودینامیک: نمیشود که از این بازی خلاص شوی.










دیدگاهتان را بنویسید